Resistente Keime werden immer gefährlicher: Weltweit werden Bakterien, Parasiten, Viren und Pilze unempfindlicher oder gar resistent gegen antimikrobielle Arzneistoffe. Die Weltgesundheitsorganisation (WHO) zählt antimikrobielle Resistenzen (AMR) zu den zehn größten Gesundheitsbedrohungen der Welt. Doch wie entstehen die multiresistenten Keime? Und warum könnte die Forschung zum „One-Health-Konzept“ die Lösung sein?
Wie entstehen resistente Keime?
Bakterien, Viren, Pilze oder Parasiten passen sich genetisch immer wieder an ihre Umwelt an – auch an die Medikamente, die gegen sie eingesetzt werden. Bakterien, beispielsweise, können so mutieren, dass bestimmte Antibiotika nicht mehr wirksam sind.
Wenn Bakterienstämme durch die Behandlung mit antibiotischen Wirkstoffen nicht mehr absterben oder in ihrem Wachstum gehemmt werden, also resistent sind, spricht man von einer Antibiotikaresistenz. Sind gleich mehrere Antibiotikaklassen wirkungslos, hat man es mit sogenannten multiresistenten Erregern (MRE) zu tun.
Warum gibt es immer mehr multiresistente Bakterien und Erreger?
Die heutige Lebenswelt begünstigt die Entstehung und Verbreitung von resistenten Erregern: Als größtes Problem sieht die WHO den viel zu häufigen und unsachgemäßen Einsatz von Antibiotika bei Menschen und Tieren. Denn dadurch bekommen Bakterien eine Art Trainingsmöglichkeit und mutieren schneller.
Verstärkt wird das Problem unter anderem durch unsere weltumspannende Mobilität, dichte Bevölkerungsstrukturen, mangelnde Hygiene, fehlende oder nur schwache Prävention in Gesundheitseinrichtungen oder Nutztierbetrieben: Das alles erleichtert resistenten Erregern eine raschere Verbreitung als je zuvor.
Wie kommt es zu übermäßigem Gebrauch von Antibiotika?
Antibiotika werden beim Menschen unter anderem deshalb zu oft eingesetzt (Übergebrauch), weil mit ihnen fälschlicherweise Grippe, Erkältungen und einen Großteil der Fälle von Halsweh und Bronchitis behandelt werden (Fehlgebrauch). Dahinter stecken jedoch meist nicht Bakterien, sondern Viren. Deshalb sollte immer erst abgeklärt werden, ob ein bakterieller Erreger vorliegt und außerdem abgeklärt werden, welches Antibiotikum am besten passt.
Auch in der Nutztierhaltung werden Antibiotika zu oft eingesetzt - mitunter dieselben wie in der Humanmedizin: Um Infektionen von Beständen zu verhindern, verabreicht man sie rein prophylaktisch. Außerdem werden Antibiotika noch immer im Rahmen der Massentierhaltung zu Mastzwecken eingesetzt. Doch je häufiger Antibiotika verwendet werden, desto mehr resistente Erreger bilden sich – "the more you use it, the quicker you lose it".
Geschichte der Antibiotika
Geschichte der Antibiotika
1928 – vor weniger als hundert Jahren – als neuartiger Wirkstoff von Alexander Fleming zufällig entdeckt und seit 1942 für eine größere Anzahl an Menschen verfügbar, war Penicillin das erste kommerziell vertriebene Antibiotikum. Antibiotika sind einer der vielen Meilensteine der Medizin und sie haben unzählige Menschenleben gerettet:
Viele der bakteriell verursachten Erkrankungen wie Sepsis (Blutvergiftungen) oder Lungenentzündungen lassen sich damit behandeln. Das gilt auch für die Seuchen unserer Vergangenheit – Pest, Cholera, Tetanus, Typhus –, die in verschiedenen Teilen der Welt immer wieder auftauchen.
90 Jahre nach der Entdeckung des Penicillins ist eine der effektivsten Behandlungsmöglichkeiten teilweise wirkungslos gegen vielfach resistente Bakterien und andere Keime geworden.
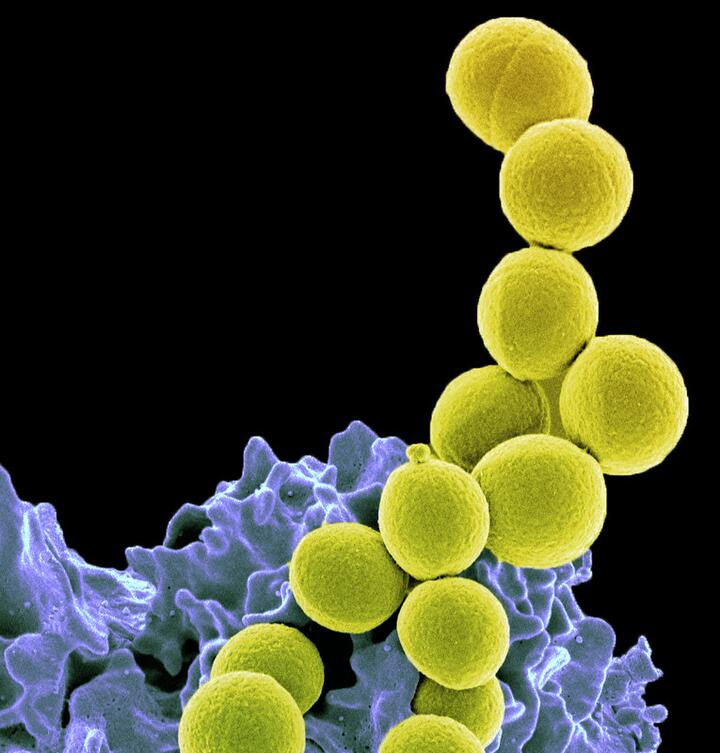
Bild: Methicillin-resistente Staphylococcus aureus-Bakterien, gebunden an ein infektionsbekämpfenden weißen Blutkörperchen.
Copyright: National Institute of Allergy and Infectious Diseases, National Institutes of Health
Wie steht es um die Reserveantibiotika?
Die WHO teilt Antibiotika in drei Kategorien ein:
- Access, Antibiotika, die weiterhin breit bei verschiedenen Infektionen eingesetzt werden können.
- Watch, Antibiotika, gegen die sich bereits Resistenzen gebildet haben und die deshalb sparsamer eingesetzt werden sollen.
- Reserve, Antibiotika, die auch bei MRE wirksam bleiben und daher nur als letzte Option bei Versagen aller Alternativen verwendet werden sollten.
Doch leider werden auch diese sogenannten Reserveantibiotka zu häufig eingesetzt – so nehmen in einigen europäischen Ländern seit 2010 beispielsweise die Resistenzen gegen Carbapeneme jährlich zu.
Wieso sind resistente Keime so gefährlich?
Es ist eine Errungenschaft der Medizin, Infektionen mithilfe von Antiinfektiva, also Arzneimitteln, die gegen bakteriell verursachte Infektionen (Antibiotika) oder gegen Pilzinfektionen (Antimykotika) wirken, behandeln zu können. Diese Errungenschaft steht auf dem Spiel.
Eingriffe wie eine Hüft-OP, ein Kaiserschnitt, eine Organtransplantation oder die Krebs-Chemotherapie werden riskanter, wenn mögliche, damit einhergehende Infektionen schwerer oder im schlimmsten Fall gar nicht mehr behandelbar sind. So haben Patienten, die im Krankenhaus einen Methicillin-resistenten Staphylococcus aureus (MRSA) erwerben, ein 64 Prozent höheres Sterberisiko als Patienten mit Erregern, die noch als empfindlich gegenüber vielen Antibiotika gelten.
Wie viele Menschen sterben durch resistente Keime?
2007 erkrankten in Europa um die 240.000 Menschen an einer Infektion mit multiresistenten Erregern (MRE), inzwischen sind es 670.000. Etwa 33.000 Menschen in Europa versterben an Infektionen durch multiresistente Erreger, weltweit sind es nach Schätzungen mindestens 700.000 pro Jahr.
Wenn sich nichts ändert, könnte die Zahl der Todesfälle durch antimikrobielle Resistenzen laut WHO bis 2050 auf bis zu 10 Millionen Menschen jährlich steigen. Damit würden sie mehr Todesopfer fordern als Krebs oder Herz-Kreislauferkrankungen, die aktuell häufigsten Todesursachen.
Was kosten antimikrobielle Resistenzen die Gesellschaft?
Neben Todesfällen und Folgen einer schweren Erkrankung sind AMR auch eine volkswirtschaftliche Belastung: Betroffene liegen länger im Krankenhaus, brauchen teurere Therapien und Pflege und fallen im Arbeitsleben länger aus.
Laut WHO belaufen sich die jährlichen finanziellen Verluste aufgrund von Krankenhausinfektionen in den USA und Europa auf 13,5 Milliarden US-Dollar. Schätzung zufolge könnten sich könnten sich die AMR-bedingten Gesamtkosten bis 2050 für das Gesundheitssystem in Deutschland auf bis zu 4,3 Milliarden Euro belaufen..
Resistente Bakterien: Wo stehen wir heute?
Laut Weltgesundheitsorganisation (WHO) nimmt die Wirksamkeit bestimmter Antibiotikaklassen gegen häufige bakterielle Infektionen wie Harnleiterentzündung, sexuell übertragene Infektionen, bestimmte Durchfälle oder Blutvergiftung ab.
Die WHO berichtet etwa von Resistenzraten von bis zu über 90 Prozent von Escherichia coli, einem Auslöser von Harnwegsinfektionen, gegenüber einem bestimmten Antibiotikum aus der Gruppe der gebräuchlichen Fluorchinolon-Antibiotika.
Für Klebsiella pneumoniae, einer der häufigsten Erreger für schwere, im Krankenhaus erworbene Infektionen, werden weltweit Resistenzen auch gegenüber Reserveantibiotika wie den Carbapenemen nachgewiesen.
In manchen Ländern, etwa Griechenland, sind sie schon nicht einmal mehr bei jedem zweiten Patienten wirksam. In Rumänien, Italien und Bulgarien liegen die Resistenzraten bei etwa einem Drittel der durch diesen Erreger verursachten Infektionen.
Und in einigen Ländern sind inzwischen Bakterien aufgetreten, die gegenüber Colistin, der eine der sehr wenigen Behandlungsmöglichkeiten für lebensbedrohliche Infektionen durch Carbapenem-resistente Enterobakterien, resistent geworden sind. Diese Therapieoptionen sollten daher sehr sorgsam eingesetzt werden.
Wie ist das mit resistenten Viren?
Auch antivirale Medikamente verlieren an Wirkungskraft durch das Auftreten von arzneimittelresistenten HIV-Stämmen (HIVDR). Diese Resistenzen können unter einer antiretroviralen Therapie entstehen – Menschen können allerdings auch mit HI-Viren infiziert werden, die bereits arzneimittelresistent sind.
Gibt es auch parasitäre Erkrankungen mit antimikrobieller Resistenz?
Auch Parasiten, die die Malaria übertragen, sind inzwischen bisweilen resistent gegenüber Arzneimitteln. Das stellt eine der größten Bedrohungen für die Malariabekämpfung dar und führt laut WHO zu einer erhöhten Malariamorbidität und -mortalität.
Resistente Pilze: Wo stehen wir heute?
Arzneimittelresistente Pilzinfektionen nehmen ebenfalls zu, so dass Pilzinfektionen schwerer behandelbar werden, insbesondere bei Patienten mit anderen zugrunde liegenden Infektionen (z. B. HIV) oder einem geschwächten Immunsystem.
Was kann man gegen Antibiotikaresistenzen tun?
Antibiotikaresistenzen können zwar nicht verhindert, durch den gezielten und reduzierten Gebrauch von Antibiotika allerdings verlangsamt werden. Hierfür wären eine gemeinsame Strategie und optimierte Kommunikationswege zwischen beispielsweise Krankenhäusern, Pflegeheimen, Rehabilitationseinrichtungen und Arztpraxen bei der Behandlung von Infektionskrankheiten wichtig.
Man muss kontrollieren, wo welche Antibiotika wie oft eingesetzt werden – und überwachen, wo und wie oft welche multiresistenten Erreger auftauchen. Dies leisten in Deutschland beispielsweise um die 100 regionale MRE-Netzwerke.
Wie wird an neuen Antibiotika geforscht?
Wenn sich Erreger verändern, muss sich auch das Gegenmittel ändern: 2019 zählte die WHO in der klinischen Entwicklung 32 mögliche Antibiotika gegen die von ihr als prioritär definierten Pathogene, nur sechs davon stufte sie als innovativ ein. Eine kritische Lücke seien Wirkstoffe gegen gram-negative Carbapenem-resistente Bakterien.
Herausforderungen aus Sicht der Pharma-Forschung:
Die Entwicklung neuer Antibiotika ist langwierig und teuer: Es dauert 10–15 Jahre und kostet schätzungsweise 2,9 Mrd. US-Dollar, um ein neues Antibiotikum zu entwickeln und auf den Markt zu bringen. Hinzu kommt: Das Risiko des Scheiterns ist hoch, denn bei neuen Antibiotikaklassen erreicht nur einer von 30 Wirkstoffkandidaten, die sich in der vorklinischen Entwicklung befinden, auch die Patient:innen. Pharmazeutische Unternehmen sind zudem mit begrenzten Umsatzerlösen konfrontiert – denn neu entwickelte Antibiotika sollen möglichst sparsam eingesetzt werden.
„One Health“: Eine Antwort auf antibiotikaresistente Bakterien und andere Keime
Die Gesundheit von Mensch, Tier und Umwelt sind eng miteinander verknüpft. Antibiotika werden überall eingesetzt: in der Humanmedizin, der Veterinärmedizin, der Landwirtschaft und in Aquakulturen. Da die Resistenzen keine Grenzen kennen, verbreiten sie sich zwischen Mensch, Tier und Umwelt gleichermaßen.
Eine wirksame Bekämpfung von Antibiotikaresistenzen ist nur möglich, wenn Humanmediziner, Veterinärmediziner und Umweltwissenschaftler zusammenarbeiten. Diesen „One-Health-Ansatz“ verfolgte die Deutsche Antibiotika-Resistenzstrategie DART 2020 und er wird voraussichtlich auch Teil der neu aufgelegten Strategie DART 2030 sein. Außerdem braucht es bessere globale Überwachungssysteme, um Ausbrüche von Infektionskrankheiten und neue antimikrobielle Resistenzstämme zu verfolgen.
Grafik: Shutterstock





Kommentare